人民日报健康客户端 陈琳辉
当地时间9月29日,美国食品药品管理局(FDA)批准了由Amylyx制药公司开发的药物Relyvrio(苯丁酸钠和牛磺酸二醇口服固定剂量配方,AMX0035)用于治疗肌萎缩侧索硬化症(ALS,俗称“渐冻症”)成人患者。该药物是首款在随机、安慰剂对照临床试验中显著延缓ALS疾病进展并能延长生存期的治疗药物,也是116年以来FDA批准的第3款ALS治疗药物。
这款疗法的获批过程可谓一波三折。今年3月,FDA咨询委员会以6:4的投票结果,表示临床数据尚不支持这款疗法的有效性。之后,Amylyx公司递交了对临床试验数据的进一步分析以及来自其它临床试验的支持数据,并首次获得加拿大监管机构的批准有条件上市。
今年6月,FDA通知Amylyx制药公司,将审查新药的最后期限延长至9月29日,以便有更多时间审查苯丁酸钠和牛磺酸二醇口服固定剂量配方(AMX0035)临床研究数据的额外分析。
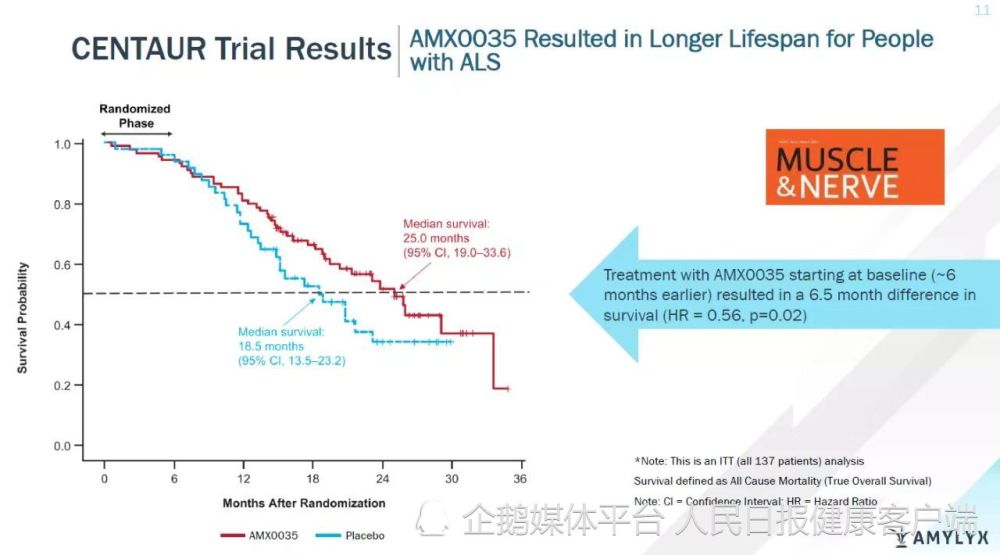 药物Relyvrio延长ALS患者生存期,Amylyx公司官网图
药物Relyvrio延长ALS患者生存期,Amylyx公司官网图
9月8日,FDA外周和中枢神经系统药物咨询委员会(PCNSDAC)以7:2的投票结果赞成Amylyx制药公司在研药物AMX0035的现有研究数据足以支持其用于治疗肌萎缩侧索硬化的上市申请。目前苯丁酸钠和牛磺酸二醇口服固定剂量配方(AMX0035)在ALS患者中的三期临床试验正在进行中,计划于2023年底或2024年初完成。
 ALS协会官网截图
ALS协会官网截图
据ALS协会官网介绍,ALS协会曾将2014年ALS冰桶挑战筹得的220万美元投资于这种药物的研发,还领导了长达数年的宣传运动,以使这一疗法获得批准,包括在2020年9月向FDA提交了超过5万个签名,呼吁FDA批准该药物。
肌萎缩侧索硬化症(ALS)是上运动神经元和下运动神经元损伤之后,导致包括球部(所谓球部,就是指延髓支配的这部分肌肉)、四肢、躯干、胸部腹部的肌肉逐渐无力和萎缩。该病一般进展迅速,半数以上患者确诊后平均生存时间为3-5年,最后多死于呼吸肌无力导致的呼吸衰竭。
此外,下一个ALS新药可能也会很快到来,今年7月渤健和Ionis制药公司的在研反义寡核苷酸疗法上市申请已获FDA受理,并同时授予其优先审评资格,审查新药的最后期限定于2023年1月25日。期待更多渐冻症创新疗法研发顺利,早日来到患者身边。





















