*仅供医学专业人士阅读参考


代谢重编程是肿瘤细胞区别于正常组织细胞的重要特征。在此过程中,显著上调的代谢酶发挥了关键作用[1]。此外,代谢酶也可通过参与信号传导,蛋白的转录后修饰等非酶依赖性的作用方式,协助肿瘤应对生存压力。
氨基己糖通路(HBP)是糖代谢的重要分支之一,它作为细胞内“能量传感器”,整合了葡萄糖代谢、谷氨酰胺分解、脂肪酸代谢和核苷酸代谢。在多种类型的癌症中,都存在HBP增强[2-3]。
谷氨酰胺-果糖-6-磷酸酰胺转移酶1(GFAT1)是HBP通路中最重要的限速酶,在多种肿瘤细胞中表达升高,并于与患者的不良预后相关[4-5]。有研究表明:在葡萄糖缺乏的情况下,GFAT1明显上调并激活HBP通路,进而维持肿瘤细胞的存活[6-7]。然而,GFAT1能否通过非酶依赖的作用参与肿瘤细胞生物过程目前尚不明确。
近日,由广州医科大学呼吸疾病国家重点实验室的陈涛、梁文华及钟南山领衔的团队,与上海交通大学医学院附属仁济医院蒋玉辉团队合作,在《细胞发现》期刊发表了有关营养压力下GFAT1促进肺腺癌细胞细胞存活的机制研究的重要成果[8]。
该研究团队证实了GFAT1对肺腺癌细胞存活的关键调控作用还发现GFAT1的作用并不依赖于其代谢调控功能,而是作为细胞内信号传导分子,促进TTLL5-GFAT1-TAB1复合物的形成,进而激活P38 MAPK信号通路,促进肺腺癌细胞的存活。
这项研究成果证实了在营养压力条件下,氨基己糖通路关键代谢酶GFAT1通过非代谢调控功能促进了肺癌细胞存活,为靶向GFAT1这一代谢靶点治疗肺癌提供了理论证据。

论文首页截图
接下来,我们就一起来来看看这个研究是如何展开的。
研究人员首先对癌症基因组图谱(TCGA)和基因型-组织表达程序(GTEx)数据库开展了基因表达谱互动分析(GEPIA),结果发现GFAT1在肺腺癌中表达明显上调。
为了探究GFAT1在肺腺癌发生中的作用,研究人员首先在肺腺癌细胞中敲除GFAT1,随后在营养压力下检测癌细胞的存活率,发现敲除GFAT1,癌细胞的存活率明显下降,同时也几乎完全抑制了p38 MAPK的激活。
随后,研究人员又过表达MKK6E,以激活p38 MAPK,结果发现明显逆转了敲除GFAT1的作用。
以上研究结果提示,GFAT1的作用可能依赖于P38 MAPK的激活。

营养压力下GFAT1的作用依赖于P38 MAPK的激活
为了探究营养压力下GFAT1的作用是否归因于其代谢活性,研究人员在稳定敲除的GFAT1肺腺癌细胞中,回补氨基葡萄糖来上调糖基化水平,结果发现肿瘤细胞生长并未恢复。
然而,在敲除GFAT1并过表达酶活性缺失的GFAT1(rGFAT1-H577A)的细胞中,回补谷氨酸后可以明显促进p38 MAPK的激活及肿瘤生长。
以上结果提示,营养压力下GFAT1通过介导谷氨酸的产生,对于P38 MAPK的激活及肿瘤的存活至关重要。
GFAT1介导谷氨酸维持了MAPK的激活及肿瘤的存活
之前有大量研究表明,TAB1和p38α MAPK的结合可以导致p38 MAPK的激活[9]。研究人员通过质谱及蛋白免疫共沉淀(IP)实验发现,GFAT1与p38 MAPK信号的关键调控蛋白TAB1存在结合。后续的实验结果表明,p38 MAPK和JNK之间的协同作用促进了TAB1上Ser438的磷酸化。
随后,通过敲低及IP实验,研究人员证实了TAB1 S438的磷酸化是GFAT1-TAB1相互作用的必要条件,是营养压力下p38 MAPK持续激活的关键。
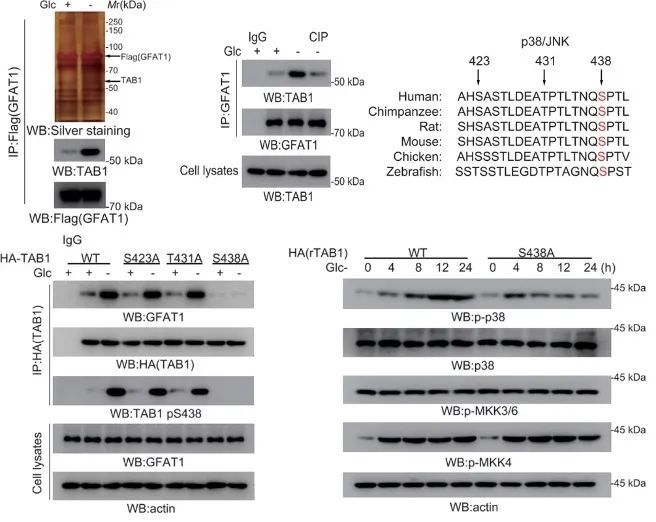
GFAT1-TAB1的相互作用是营养压力下p38 MAPK持续激活的关键
在探索过程中,研究人员还发现一个有趣的现象:GFAT1-TAB1与TAB1-p38 MAPK的相互作用存在相关。究其背后原因,研究人员发现在营养压力下,GFAT1与TAB1的结合导致了TAB1-p38α的结合,进而激活了p38 MAPK,维持了细胞生存。
接下来,研究人员对GFAT1对TAB1产生的修饰作用进行探索。结合之前GFAT1介导产生的谷氨酸所发挥的关键作用及质谱及IP结果,研究人员通过大量实验证实,在营养压力下,GFAT1与TTLL5的结合增加,从而对TAB1上Glu 212进行谷氨酰胺化修饰。这一构象改变促进了TAB1与p38α MAPK的结合,从而激活了p38 MAPK。
为了探究GFAT1-TTLL5对TAB1的谷氨酰胺化作用是否依赖于GFAT1介导产生的谷氨酸,研究人员通过回补谷氨酸实验发现,谷氨酸明显地促进TAB1谷氨酸化和TAB1-p38α MAPK复合物的形成,进一步实验证实,在营养压力下,GFAT1通过产生谷氨酰胺从而促进GFAT1-TTLL5-TAB1复合物的形成,介导TAB1谷氨酸化。

GFAT1催化的谷氨酸的产生是否导致了TTLL5介导的TAB1谷氨酸化
我们都知道,在营养压力下,肿瘤细胞可以通过上调自噬从而维持细胞存活,而p38 MAPK的激活对于细胞自噬至关重要。
为了探究GFAT1-TAB1-p38轴是否影响了细胞自噬,研究人员检测了细胞凋亡和自噬水平,发现GFAT1酶活丢失抑制了葡萄糖缺乏导致的肿瘤细胞自噬,而这一作用可被外源性回补谷氨酸所逆转。此外,TAB1 Ser438的突变几乎完全抑制了自噬,且无法被外源性补充谷氨酸所逆转。
与此同时,在GFAT1酶活丢失及TAB1磷酸化位点的突变的细胞中,过表达MMK6E激活p38 MAPK后,可明显促进肿瘤细胞存活和自噬水平的上调。十分有趣的是,在营养压力下,TAB1 Ser438的突变可以促进细胞凋亡,这一现象也可被过表达MMK6E以激活p38 MAPK所逆转。
以上结果说明,在营养压力下,GFAT1-TTLL5-TAB1复合物介导的p38 MAPK激活,通过调控细胞凋亡及自噬影响了肺腺癌细胞的存活。

GFAT1-TTLL5-TAB1复合物调控细胞自噬提高了肺腺癌细胞的存活
为了在体内验证GFAT1-TAB1-p38轴对肺腺癌发展的作用,研究人员向裸鼠内分别注射WT rTAB1、rTAB1-S438A(磷酸化位点突变)或rTAB1-E212A(谷氨酰胺化位点突变)的肺腺癌细胞,对肿瘤生长及p38的激活进行评估。
结果他们发现,TAB1的磷酸化和谷氨酸化对于p38激活和肿瘤生长所必须的。这提示GFAT1-TAB1-p38轴的激活促进了肺腺癌肿瘤的形成。
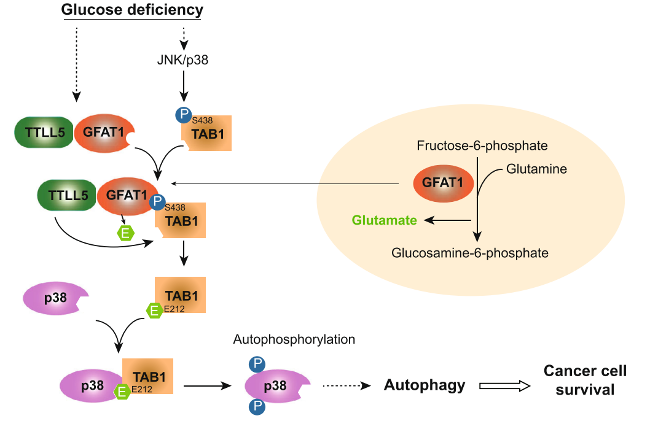
文章机制图
除此之外,研究人员还在肺癌患者术后标本中观察到了p38激活和TAB1 S438磷酸化水平之间存在正相关。对患者生存期进行评估发现,GFAT1表达升高及TAB1 S438磷酸化水平升高,提示肺癌患者较差的预后。
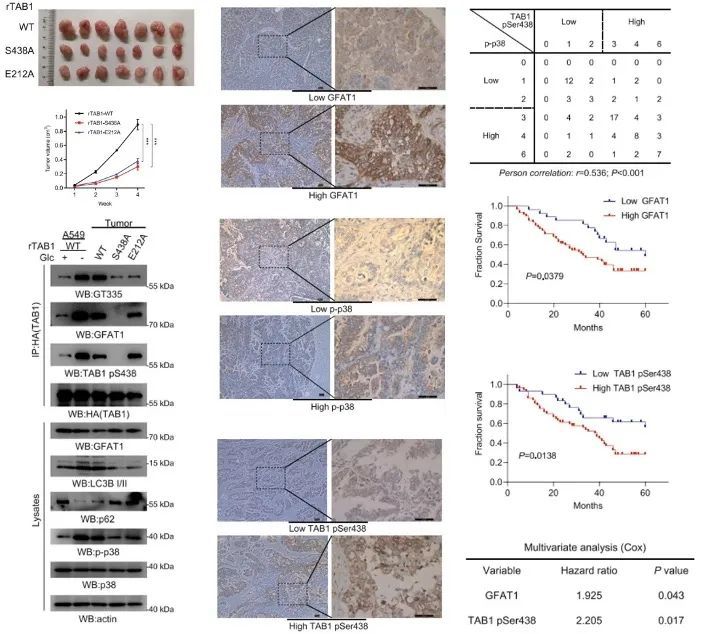
GFAT1-TAB1-p38在对于肺腺癌发展中发挥关键作用
总的来说,研究人员证实了GFAT1通过促进GFAT1-TTLL5-TAB1复合物的形成,产生对TAB1的谷氨酰胺化修饰,进而激活p38 MAPK。
这项研究首次揭示了GFAT1作为信号传导分子在肺腺癌进展中的关键作用,为未来靶向GFAT1这一代谢靶点治疗肺癌提供了理论证据。


已购买课程的朋友,
直接进入小程序收听加餐哦~
参考文献
[1] Hay N. Reprogramming glucose metabolism in cancer: can it be exploited for cancer therapy?. Nat Rev Cancer. 2016;16(10):635-649. doi:10.1038/nrc.2016.77
[3] Chiaradonna F, Ricciardiello F, Palorini R. The Nutrient-Sensing Hexosamine Biosynthetic Pathway as the Hub of Cancer Metabolic Rewiring. Cells. 2018;7(6):53. Published 2018 Jun 2. doi:10.3390/cells7060053
[4] Li L, Shao M, Peng P, et al. High expression of GFAT1 predicts unfavorable prognosis in patients with hepatocellular carcinoma. Oncotarget. 2017;8(12):19205-19217. doi:10.18632/oncotarget.15164
[5] Yang C, Peng P, Li L, et al. High expression of GFAT1 predicts poor prognosis in patients with pancreatic cancer. Sci Rep. 2016;6:39044. Published 2016 Dec 20. doi:10.1038/srep39044
[6] Moloughney JG, Vega-Cotto NM, Liu S, et al. mTORC2 modulates the amplitude and duration of GFAT1 Ser-243 phosphorylation to maintain flux through the hexosamine pathway during starvation. J Biol Chem. 2018;293(42):16464-16478. doi:10.1074/jbc.RA118.003991
[7] Moloughney JG, Kim PK, Vega-Cotto NM, et al. mTORC2 Responds to Glutamine Catabolite Levels to Modulate the Hexosamine Biosynthesis Enzyme GFAT1. Mol Cell. 2016;63(5):811-826. doi:10.1016/j.molcel.2016.07.015
[9] Ge B, Gram H, Di Padova F, et al. MAPKK-independent activation of p38alpha mediated by TAB1-dependent autophosphorylation of p38alpha. Science. 2002;295(5558):1291-1294. doi:10.1126/science.1067289

责任编辑丨BioTalker