*仅供医学专业人士阅读参考
癌细胞的一大可恨之处,就是把人体内好好的免疫细胞“带坏”,变成为非作歹的帮凶,所以看到“肿瘤相关”这个前缀,奇点糕就有种恨铁不成钢的感觉。
就拿巨噬细胞来说,本来它们应该是吞噬和消灭人体内各种外敌的主力,然而一旦到了肿瘤微环境内,摇身一变成为肿瘤相关巨噬细胞(TAMs),它们就立刻开始用各种方式促进癌症进展,还会影响抗癌治疗的效果,用四个字来形容就是:
坏 事 做 绝。
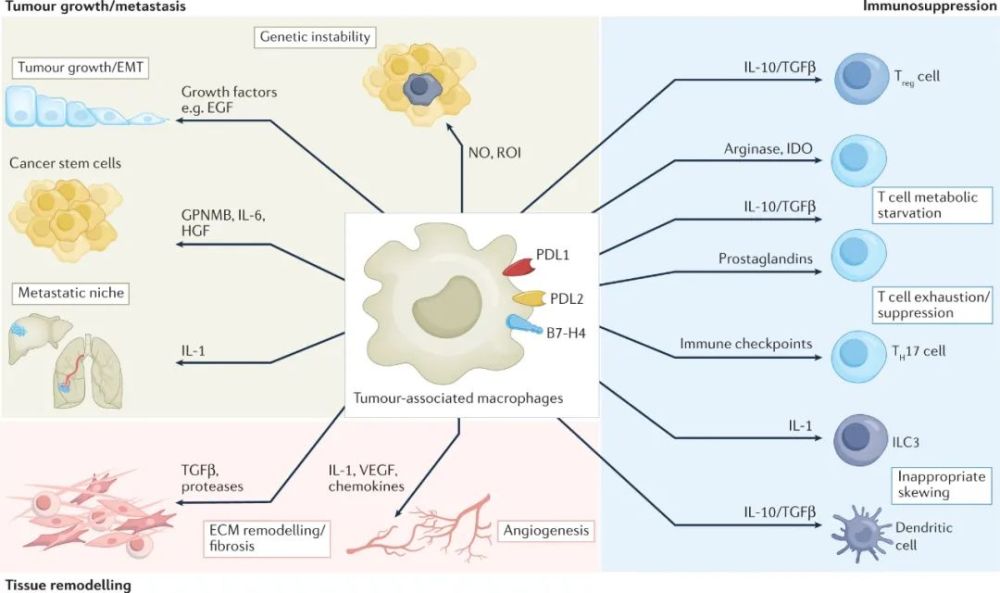
TAMs的促癌和免疫抑制机制
不过换个角度来看,既然巨噬细胞有可能被癌细胞拖下水,那说明它们还是有着很强的可塑性,找到正确的打开方式,把巨噬细胞挽救回来,不就能发挥抗癌作用吗?
也正是基于这些考量,围绕巨噬细胞展开的在研抗癌创新疗法五花八门,增强巨噬细胞招募的、调节TAMs极化的、激活或抑制特定细胞因子/趋化因子的,乃至给巨噬细胞也加装嵌合抗原受体(CAR)……
近期在《自然评论·药物发现》(Nature Reviews Drug Discovery)上,意大利米兰Humanitas大学医院的四位专家,就深度盘点了巨噬细胞作为癌症治疗中靶点和工具的意义[1]。基于巨噬细胞的治疗策略进展如何呢?一起来看!
TAMs的多样性及其对预后的影响
当前研究认为,肿瘤微环境中的TAMs由两部分构成,一部分是来自胚胎期就存在的组织驻留型巨噬细胞,它们在癌症发生的早期营造了有利于癌症的微环境,比较典型的就是小胶质细胞(中枢神经系统的巨噬细胞)对胶质瘤的促癌作用;而另一部分随后赶到的主力TAMs,则源自骨髓来源的单核前体细胞。
被募集到肿瘤部位后,受TGF-β、CCL2、IL-1/4等细胞因子、趋化因子乃至肿瘤组织中微生物的影响,TAMs会进入抑制抗肿瘤免疫应答的2型炎症应答状态,即向M2表型极化,而且还可以细分为许多功能和基因表达不同的亚群。
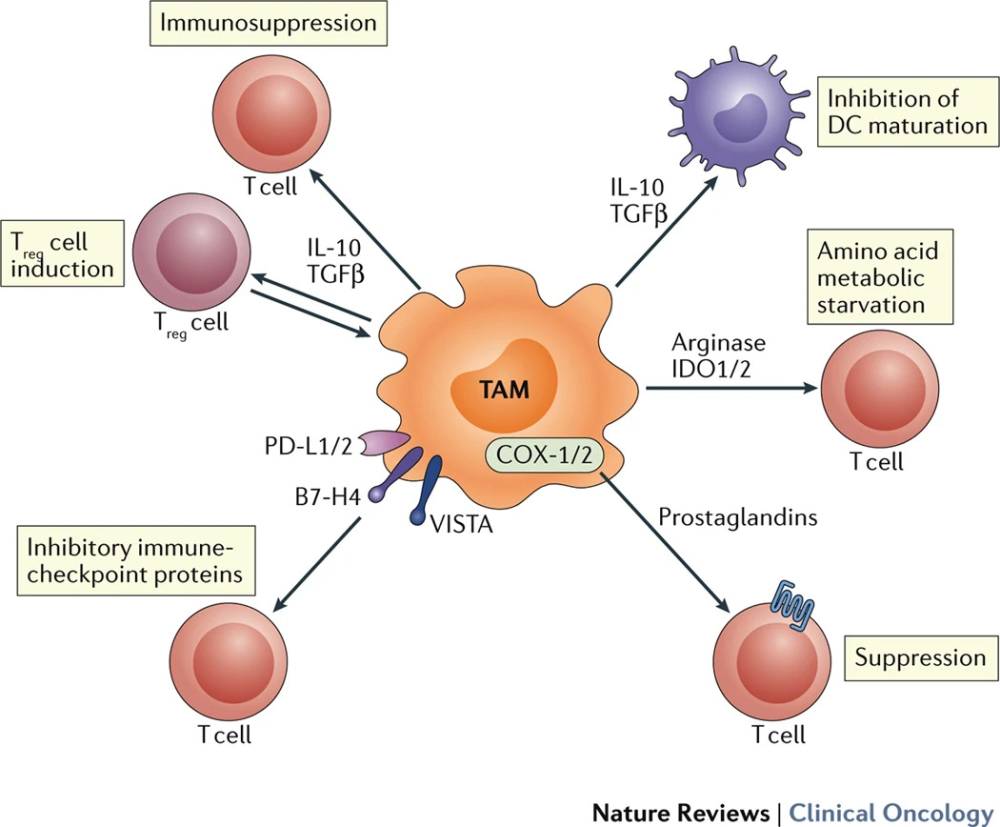
TAMs可能的免疫抑制机制
整体而言,TAMs在肿瘤中大量浸润,往往提示患者预后不佳,但由于肿瘤部位和生物学行为差异,这种关系也不是绝对的,例如有研究发现在结直肠癌中,TAMs浸润多与预后较好有关,但在结直肠癌肝转移灶中结论就得反过来[2-3]。
TAMs在传统抗癌治疗中的角色
由于TAMs对抗肿瘤免疫应答有着举足轻重的调节作用,化疗、放疗、内分泌治疗、抗血管生成治疗乃至免疫治疗,都会不同程度受到TAMs的影响,但这些治疗手段也会反过来作用于TAMs,呈现一种既有合作、又有斗争的格局。
例如各种单抗类药物的起效,往往就离不开抗体依赖的细胞吞噬作用(ADCP);而TAMs激活的信号通路,也可能限制化疗药物的疗效,甚至参与介导耐药。同时TAMs对肿瘤新生血管也有关键影响,会直接影响抗血管生成药物的疗效。
胰腺癌化疗常用的吉西他滨、肠癌化疗的老将氟尿嘧啶,以及经典的含铂双药化疗,则能够让TAMs由M2表型向M1表型极化,从而有利于抗肿瘤免疫;已获FDA批准的肺癌化疗新药lurbinectedin,更是能直接诱导TAMs的凋亡。
撰写本文的意大利专家们,在2017年一篇发表于《自然评论·临床肿瘤学》的综述中,就用“阴阳两极”来形容TAMs对化疗、放疗等传统治疗手段的影响,不过五年后的今天,大家更关注的自然是TAMs与免疫治疗间的“爱恨情仇”。
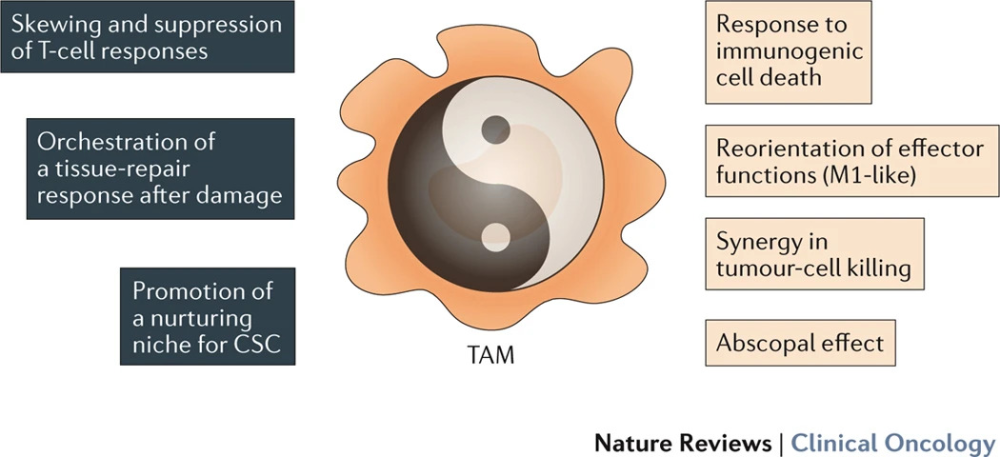
所谓“阴阳两极”
TAMs与现有免疫治疗的关系
含巨噬细胞在内的髓单核细胞(Myelomonocytic cells),是肿瘤微环境中介导免疫抑制的主要“黑手”,因为这类细胞表面往往有PD-L1/L2、B7-1/2等免疫检查点的配体,且巨噬细胞还可能表达T细胞、NK细胞负调控因子的相应受体,如T细胞活化的V域免疫球蛋白抑制因子(VISTA)等,从而抑制抗肿瘤免疫应答。
在三阴性乳腺癌、肾癌等肿瘤中的研究已经证实,巨噬细胞可能通过诱导T细胞凋亡、抑制T细胞增殖等途径,介导免疫检查点抑制剂的原发/继发性耐药[4-5],因此采用放疗、单抗治疗等各种手段清除巨噬细胞,以增强免疫治疗效果的研究不在少数。不过比起直接对巨噬细胞赶尽杀绝,另一种思路也值得一试。
改造TAMs的主要思路与研究进展
由于TAMs有着一定的可塑性,恰当的治疗手段仍有望让TAMs改邪归正,成为免疫治疗的助力,目前的探索主要围绕M2表型TAMs,在以下几个方向开展:
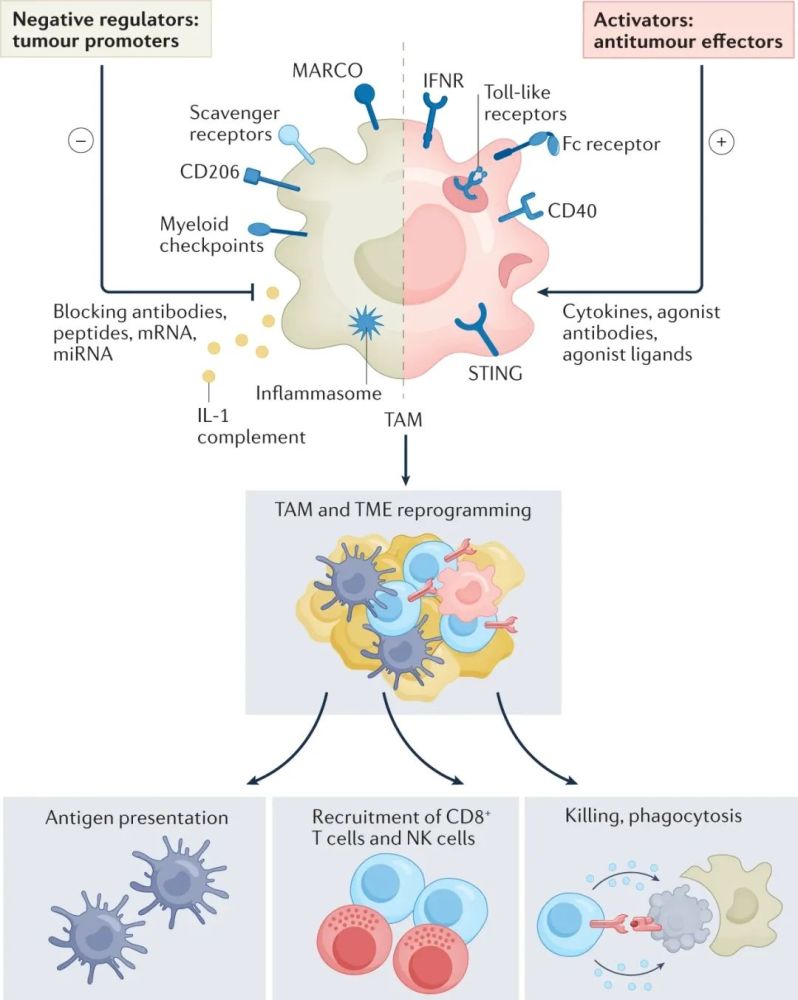
对TAMs重编程的主要探索方向
1)针对TAMs的募集和积聚
巨噬细胞集落刺激因子(CSF1)和CCL2等多种趋化因子,对单核细胞在肿瘤微环境中的募集和执行的具体功能有重要影响,但靶向CSF1/CCL2相应受体的单抗类药物,却未能在临床研究中取得治疗获益,开发大多已经终止。有研究认为应考虑针对特定的TAMs亚群,而不是笼统地以全部TAMs作为治疗目标。
2)补体系统
补体系统中的瘦素(lectin)信号通路以及C3a、C5a等成分,都被证实与TAMs向肿瘤微环境的募集和发挥免疫抑制功能有关,且临床前研究显示,阻断补体成分的治疗药物与PD-1抑制剂存在协同增效性[6],后续临床研究正在推进之中。
3)炎症小体和IL-1
白介素-1(IL-1)能通过增强TAMs的免疫抑制功能来促癌,而临床前研究显示,靶向IL-1β则会反制这种促癌作用[7],这可能解释了卡那单抗(canakinumab)的抗癌作用。除直接靶向IL-1β外,针对免疫通路更上游的NLRP3等炎症小体进行抑制,也可能削弱TAMs免疫抑制功能,但相关临床研究受疫情影响而搁置。
4)mRNA和miRNA
已有研究尝试以纳米载体搭载特定转录因子的mRNA,注射到肿瘤部位以在基因层面对TAMs实现重编程,进而逆转免疫微环境抑制状态[8];基于miRNA的干预手段,则选择了对TAMs分化和极化有重要影响的miR-155等目标,同样在临床前研究中表现出抑癌作用。
让TAMs“重新强大”
除重编程TAMs外,还有多种策略重新激活TAMs的抗癌功能。
·利用信号分子激活巨噬细胞
意大利专家们主要提到了以下三类激活信号:
1)CD40
CD40与其配体CD40L结合后能激活正反馈通路,激活肿瘤坏死因子(TNF)和活性氧的产生,从而进一步正向调控TAMs参与抗肿瘤免疫应。临床前研究显示,靶向CD40的单抗可“重教育”免疫抑制性TAMs,使其转化为细胞毒性表型,相关药物正处于临床早期研究阶段。
2)Toll样受体(TLRs)
TLR激动剂因其激活免疫应答的功能,近年来在多种疾病中备受关注,而TLR激动剂所激活的免疫应答往往正是由TAMs调控的。从临床前研究来看,TLR激动剂也能对TAMs起到重编程作用。
3)STING
STING通路调节的免疫应答较为广泛,因此对TAMs的影响是非特异性的。
·对巨噬细胞检查点“下手”
与各种T细胞类似,TAMs的功能也会受到很多检查点的调控,如信号调节蛋白α(SIRPα)、唾液酸结合免疫球蛋白样凝集素(SIGLECs)、白细胞免疫球蛋白样受体B(LILRB)、CD163等有促炎功能的“清道夫受体”,以及正常细胞表面针对巨噬细胞的“别吃我”信号分子CD47(与巨噬细胞上的SIRPα结合)等。
此外,巨噬细胞表面还存在PD-1、TREM2、PSGL1等表达不局限于髓单核细胞系的检查点,癌细胞则常常趁虚而入,利用这些抑制性的检查点逃避抗肿瘤免疫,新一代免疫治疗也在将这些作用机制各异的检查点作为目标。
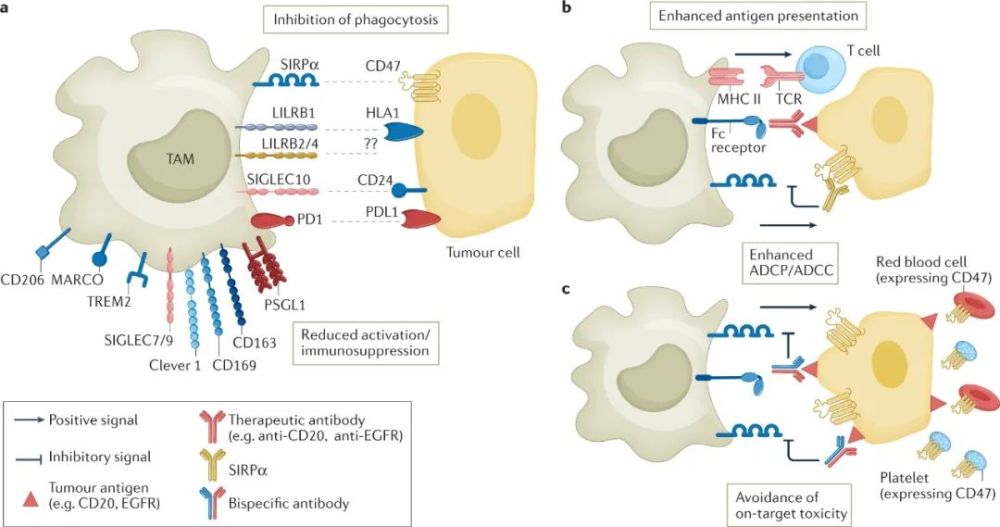
巨噬细胞表面的免疫检查点或其它细胞表面存在的抑制性受体
从早期研究来看,靶向CD47/SIRPα等通路不仅能激活TAMs的吞噬功能,配合现有的PD-1/L1抑制剂,还能通过增强ADCP效应,与利妥昔单抗、曲妥珠单抗等经典靶向药实现协同增效[9],也期待这些探索在临床研究中转化出成果。
·从TAMs的代谢切入
TAMs功能的改变,以及进入肿瘤微环境后对乏氧、乏营养状态的适应,必然会使TAMs对脂质、氨基酸等物质的代谢过程发生重编程,而HDAC抑制剂、IDO1抑制剂、二甲双胍(抑制糖酵解)等药物都可能在这方面有发挥的空间。
基于巨噬细胞的细胞免疫疗法
基于巨噬细胞的细胞免疫疗法有着一条独特的优势——血液内循环的单核吞噬细胞会被持续招募到肿瘤部位,成为源源不断的援军,所以用嵌合抗原受体(CAR)技术打造的CAR-M疗法也在进行早期探索,经过改造的巨噬细胞能够无惧免疫抑制性微环境,维持抗肿瘤的M1表型,有效杀伤癌细胞。
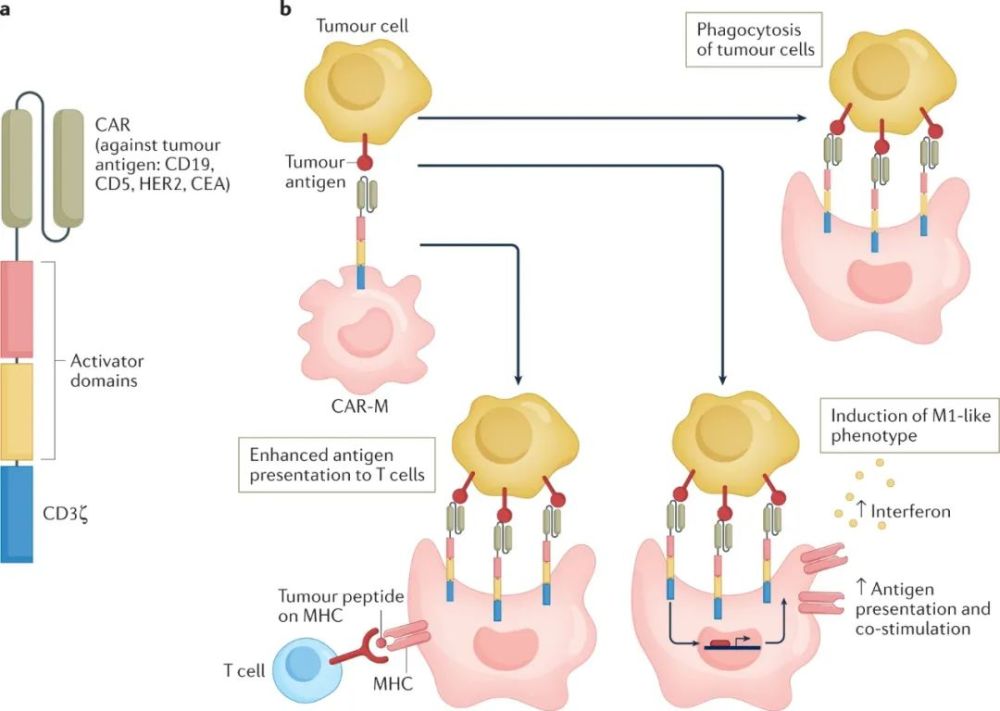
CAR-M疗法的作用机制
总结
巨噬细胞在癌症的发生发展中有着极为重要的作用,从化疗到免疫治疗的各种治疗手段,疗效也会受到巨噬细胞的影响,但由于涉及到的机制和通路非常复杂,目前的治疗探索大多还处于起步阶段,需要从功能表型、细胞代谢、免疫检查点等多个角度深入挖掘,从而实现利用巨噬细胞治疗癌症、乃至预防癌症的目标。
已购买课程的朋友,
直接进入小程序收听加餐哦~
参考文献:
1.Mantovani A, Allavena P, Marchesi F, et al. Macrophages as tools and targets in cancer therapy[J]. Nature Reviews Drug Discovery, 2022.
2.Forssell J, Öberg A, Henriksson M L, et al. High macrophage infiltration along the tumor front correlates with improved survival in colon cancer[J]. Clinical Cancer Research, 2007, 13(5): 1472-1479.
3.Donadon M, Torzilli G, Cortese N, et al. Macrophage morphology correlates with single-cell diversity and prognosis in colorectal liver metastasis[J]. Journal of Experimental Medicine, 2020, 217(11): e20191847.
4.Yu J, Green M D, Li S, et al. Liver metastasis restrains immunotherapy efficacy via macrophage-mediated T cell elimination[J]. Nature Medicine, 2021, 27(1): 152-164.
5.Chow A, Schad S, Green M D, et al. Tim-4+ cavity-resident macrophages impair anti-tumor CD8+ T cell immunity[J]. Cancer Cell, 2021, 39(7): 973-988. e9.
6.Ajona D, Ortiz-Espinosa S, Moreno H, et al. A Combined PD-1/C5a Blockade Synergistically Protects against Lung Cancer Growth and MetastasisAnti–PD-1 and Anti-C5a Combined Immunotherapy in Lung Cancer[J]. Cancer Discovery, 2017, 7(7): 694-703.
7.Aggen D H, Ager C R, Obradovic A Z, et al. Blocking IL1 Beta Promotes Tumor Regression and Remodeling of the Myeloid Compartment in a Renal Cell Carcinoma Model: Multidimensional AnalysesTargeting IL1 Beta for Kidney Cancer Immunotherapy[J]. Clinical Cancer Research, 2021, 27(2): 608-621.
8.Zhang F, Parayath N N, Ene C I, et al. Genetic programming of macrophages to perform anti-tumor functions using targeted mRNA nanocarriers[J]. Nature Communications, 2019, 10(1): 1-16.
9.Ring N G, Herndler-Brandstetter D, Weiskopf K, et al. Anti-SIRPα antibody immunotherapy enhances neutrophil and macrophage antitumor activity[J]. Proceedings of the National Academy of Sciences, 2017, 114(49): E10578-E10585.
本文作者丨谭硕




















